蛋白质印迹法实验步骤(荧光)
对于荧光性蛋白质印迹法,我们强烈推荐使用 TrueBlack® Fluorescent Western Blot Blocking Buffer Kit #40683。该试剂盒经专门配制,以通过阻断荧光团标记抗体与蛋白质印迹膜之间的非特异性相互作用,提高荧光性蛋白质印迹分析的特异性和灵敏度。与标准抗体稀释剂和封闭液相比,使用 TrueBlack® Fluorescent Western Blot Blocking Buffer Kit 时产生更少的背景和更亮的目标信号。如果使用这款试剂盒,请使用产品网页或数据表上的试剂盒专用实验步骤。
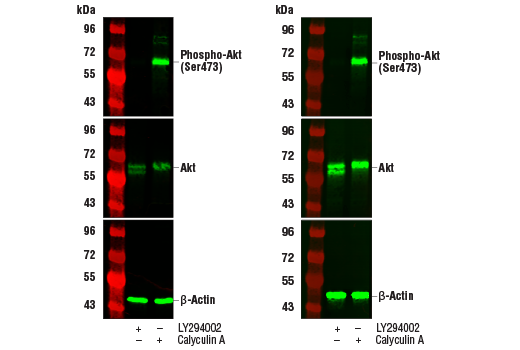
使用 Phospho-Akt (Ser473) (D9E) XP® Rabbit mAb #4060(上图)、Akt (pan) (C67E7) Rabbit mAb #4691(中图)或 β-Actin (D6A8) Rabbit mAb #8457(下图),对未经处理 (-) 或已经 LY294002 #9901 或 Calyculin A #9902 处理 (+) 的 Jurkat 细胞的提取物进行蛋白质印迹分析。使用我们的标准抗体稀释剂和封闭液(左图)或 TrueBlack® Fluorescent Western Blot Blocking Buffer Kit(右图)处理蛋白质印迹膜。使用 TrueBlack® Fluorescent Western Blot Blocking Buffer Kit 时,可观察到抗体灵敏度增加,背景荧光减少。
注:双色蛋白质印迹法需要不同物种的一抗和标记有不同染料的二抗。表位重叠可能造成干扰,因而应当在双色蛋白质印迹法中加以考虑。如果一抗需要不同的一抗孵育缓冲液,则在两种缓冲液中分别对每种一抗进行检验,以确定最适合进行双重标记实验的缓冲液。
对于蛋白质印迹法,在 4°C 下,将膜在含有 5% w/v BSA 或脱脂奶粉的 1X TBS、0.1% Tween® 20 中与稀释的一抗共同孵育,轻摇,过夜。请参阅一抗产品网页,了解推荐的一抗稀释缓冲液和抗体稀释度。
A. 溶液与试剂
注:利用反渗透去离子水 (RODI) 或同等级别的水配制溶液。
- 20X 磷酸盐缓冲液 (PBS):(#9808) 欲制备 1 L 1X PBS:添加 50 ml 20X PBS 至 950 ml dH2O,混合。
- 10X Tris 盐缓冲液 (TBS):(#12498) 欲制备 1 L 1X TBS:添加 100 ml 10X TBS 至 900 ml dH2O 中,混匀。
- 1X SDS 样品缓冲液:Blue Loading Pack (#7722) 或 Red Loading Pack (#7723) 通过添加 1/10 体积的 30X DTT 至 1 体积的 3X SDS 上样缓冲液,制备新鲜的 3X 还原上样缓冲液。用 dH2O稀释至 1X。
- 10X Tris-Glycine SDS 电泳缓冲液:(#4050) 欲制备 1 L 1X 电泳缓冲液:添加 100 ml 10X 电泳缓冲液至 900 ml dH2O 中,混匀。
- 10X Tris-Glycine 转移缓冲液:(#12539) 欲制备 1 L 1X 转移缓冲液:添加 100 ml 10X 转移缓冲液至 200 ml 甲醇 + 700 ml dH2O 中,混匀。
- 10X Tris Buffered Saline with Tween® 20 (TBST-10X):(#9997) 制备 1 L 1X TBST:加 100 ml 的 10X TBST 到 900 ml 的 dH2O 中,混匀。
- 脱脂奶粉:(#9999)。
- 封闭缓冲液:含有 5% w/v 脱脂奶粉的 1X TBS;如果制备 150 ml,加 7.5 g 脱脂奶粉到 150 ml 1X TBS 中并混匀。Tween® 20 不应添加至封闭液中,因为它具有自发荧光并且会增加非特异性背景。在封闭步骤之后,随后的稀释剂缓冲液中再添加 Tween® 20。
- 洗涤缓冲液:1X TBST。
- Bovine Serum Albumin (BSA):(#9998)。
- 一抗稀释缓冲液:1X TBST 含有 5% BSA 或 5% 脱脂奶粉,见一抗数据表;如果制备 20 ml,加 1.0 g BSA 或脱脂奶粉到 20 ml 1X TBST 中,并混匀。
- 二抗稀释缓冲液:含有 5% 脱脂奶粉的 1X TBST;如果制备 20 ml,加 1.0 g 脱脂奶粉到 20 ml 1X TBST 中并混匀。(二抗;抗兔 #5151 和 #5366;抗小鼠 #5257 和 #5470)。
- Prestained Protein Marker, Broad Range (11-190 kDa):(#13953)。
- 印迹膜和纸:(#12369) 本实验步骤已针对硝酸纤维素膜进行了优化(推荐)。通常推荐孔径0.2 µm的膜。
B. 蛋白质印迹
制备样品的常规流程。
- 使用含有调节因子的新鲜培养基对细胞进行一段时间的处理。
- 从培养物中吸出培养基;使用冷的 1X PBS 洗涤细胞;吸取。
- 加入1X SDS 样本缓冲液(6孔板每孔100 µl或直径10 cm 板每板500 µl)裂解细胞。立即从板上刮下细胞并将提取物转移至微量离心管。置于冰上。
- 超声裂解10–15秒,完成细胞裂解并剪切 DNA(以减轻样本粘度)。
- 加热20 µl 样本至95–100°C 5分钟;在冰上冷却。
- 用微量离心机离心 5 分钟。
上样20µl至 SDS-PAGE 凝胶(10 cm x 10 cm)。
注:建议将预染蛋白分子量标准品(#59329,10 µl/泳道)上样以验证电转移和确定分子量。预染标准品在近红外波长范围内具有自发荧光。
- 电转移至硝酸纤维素膜 (#12369)。
C. 膜封闭和抗体孵育
注:体积适用于 10 cm x 10 cm (100 cm2) 的膜;针对不同尺寸的膜,请对体积作出相应调整。
- (可选)转移后,在室温用 25 ml TBS 冲洗硝酸纤维素膜 5 分钟。
室温下用 25 ml 封闭缓冲液孵育膜 1 小时。
关键步骤:切勿在封闭液中加入 Tween® 20 (A 部分,步骤 8)。
- 用 15 ml TBST 冲洗三次,每次 5 分钟。
- 在 10 ml 一抗稀释缓冲液中 4°C 过夜孵育膜和一抗(按照如产品说明书中建议的适当稀释度),同时温和振荡。
- 用 15 ml TBST 冲洗三次,每次 5 分钟。
- 将膜与荧光素偶联的二抗(#5470、#5257、#5366、#5151)(稀释度为 1:5000–1:25,000 的 1 mg/ml 原液)在室温下于 10 ml 二抗稀释缓冲液中孵育 1 小时,并不时轻轻晃动。
- 用 15 ml TBST 冲洗三次,每次 5 分钟。
D. 蛋白质检测
将膜上多余的 TBST 沥干,可使其干燥。
关键步骤:对于荧光染色,必须确保膜干燥。
- 请使用合适的荧光扫描仪并根据制造商的建议扫描膜。
2022 年 3 月发布
2022 年 3 月修订
